SF6 veya sülfür hekzaflorür gaz molekülleri, bir sülfür ve altı florin atomu ile birleştirilir. Bu gaz ilk olarak 1900 yılında Paris’teki Faculte de Pharmacie de laboratuvarlarında üretildi. 1937 yılında General Electrical Company, SF6 gazının gazlı yalıtım malzemesi olarak kullanılabileceğini fark etti.
İkinci Dünya Savaşı’ndan sonra, yani 20. yüzyılın ortalarında, kükürt heksaflorür gazının elektrik sisteminde yalıtım malzemesi olarak kullanılmasının popülaritesi çok hızlı bir şekilde artıyordu. Allied Chemical Corporation ve Pennsalt, 1948’de bu gazı ticari olarak üretmeye başlayan ilk Amerikan endüstrileriydi. 1960 yılında, yüksek gerilim şalt tesislerinde kükürt heksaflorür gazının kullanımı popüler hale geldi.
Bu gaza olan talep arttıkça, Avrupa ve Amerika’daki birçok üretici bu süre zarfında büyük ölçekte SF6 gazı üretmeye başladı. Başlangıçta SF6 gazı, elektrik sisteminde sadece yalıtım amacıyla kullanılıyordu. Ancak kısa süre sonra bu gazın muazzam ark söndürme özelliğine sahip olduğu anlaşıldı. Bu nedenle, bu gaz aynı zamanda kesicilerde ark söndürme ortamı olarak da kullanılmaya başlandı.
Dünyanın ilk SF6 gaz yalıtımlı trafo merkezi 1966 yılında Paris’te kuruldu. Sülfür hekzaflorür orta gerilim devre kesiciler 1971’den itibaren piyasaya sürüldü.
İçindekiler →
SF6 Gazı İmalatı
SF6 gazı ticari olarak florin (elektroliz ile elde edilen) kükürt ile reaksiyonu ile üretilir.Bu gazın üretilme sürecinde SF 4 , SF 2 , S 2 F 2 , S 2 F 10 gibi diğer yan ürünler de küçük oranlarda üretilir. Sadece bu yan ürün, hava, nem, ve CO gibi safsızlıklar 2 üretimi sırasında, gaz içinde mevcut bulunmaktadır. Tüm bu yan ürünler ve safsızlıklar, saf ve rafine nihai ürünü elde etmek için farklı saflaştırma aşamalarında filtrelenir.
SF6 Gazının Kimyasal Özellikleri
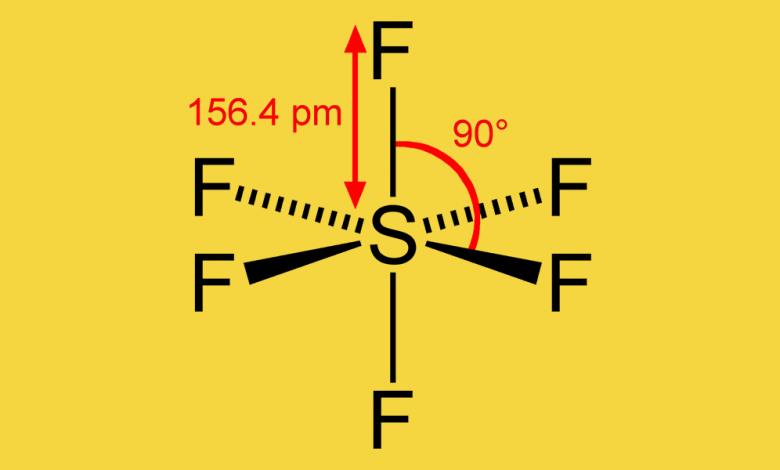
SF6 gazının kimyasal özelliklerini incelemek için önce SF6 molekülünün yapısını tanıtıyoruz. Bu gaz molekülünde bir kükürt atomu altı flor atomu ile çevrilidir.
Kükürt atom numarası 16’dır. Kükürt atomunun elektronik konfigürasyonu 2, 8, 6 yani 1S 2 2S 2 2P 6 3S 2 3P 4 tür. Flor atomu atom numarasına 9 sahip flor elektronik konfigürasyonu 1S 2 2S 2 2P 5 . SF 6 molekülündeki her bir kükürt atomu, 6 flor atomu ile kovalent bir bağ oluşturur. Bu şekilde kükürt atomu dış kabuğunda toplam 6 kovalent bağ, yani 6 çift elektron alır ve her flor atomu en dıştaki kabuğunda 8 elektron alır.
Not: Burada kükürt heksaflorür dış kabuğunda kükürt atomunun 8 elektron yerine 12 elektrona sahip olduğunu görebiliriz. Bu, burada kükürdün, kararlı bir atomun en dış kabuğunda 8 elektrona ihtiyaç duyduğunu belirten genel atomik yapının sekizlik kuralına uymadığı anlamına gelir . Bu istisnai bir durum değil. 3. periyot ve altındaki bazı elementler, en dış kabuğunda 8 elektronu aşan bir bileşik oluşturabilir. Bu gazın moleküler yapısı aşağıda gösterilmiştir.

Bu şekilde SF6, kararlı bir yapısal koşulu tamamen karşılar. Bir sülfür hekzaflorür molekülünün etkili yarıçapı 2.385 A’dır. Bu gazın bu elektronik konfigürasyonu ve yapısı SF 6’yı son derece kararlı hale getirir . Gaz moleküler yapısında herhangi bir bozulma olmadan 500 o C’ye kadar stabil olabilir . Yüksek derecede yanıcı değildir. H 2 O ve Cl bu gazla reaksiyona giremez. Ayrıca asitle reaksiyona girmez.
SF 6 gazı en ağır gazlardan biridir. 20 ° C’de, bu gaz yoğunluğu o bir atmosfer basıncında C, 6,139 kg / yaklaşık 3 aynı koşullar altında havadan daha fazla 5 kez hakkındadır. Bu gazın moleküler ağırlığı 146.06’dır. Basıncın sıcaklıkla değişimi, sülfür heksaflorür için doğrusaldır ve servis sıcaklığı içinde küçüktür, yani – 25 ila + 50 o C arasındadır. Bu gazın hacimsel özgül ısısı da yüksektir. Havadan yaklaşık 3,7 kat daha fazladır ve bu nedenle bu gazın elektrikli ekipmanlarda da muazzam bir soğutma etkisi vardır. Bu gazın ısıl iletkenliği çok yüksek değil, havadan bile düşüktür. Yine de soğutma etkisi için oldukça uygundur.devre kesici . Bunun nedeni, kükürt heksaflorür moleküllerinin elektrik arkı etrafında ayrışması sırasında, bu moleküllerin yüksek miktarda ısıyı emmesidir. Bu ısı daha sonra moleküller arkın çevresinde yeniden şekillendiğinde açığa çıkar . Bu işlem, ısının sıcak bir bölgeden soğuk bölgeye çok hızlı bir şekilde aktarılmasına yardımcı olur. Bu yüzden; SF termal iletkenliği, ancak bu gaz yüksek sıcaklıkta mükemmel soğutma etkisi vardır 6 çok yüksek değildir.
SF 6 Gazının Elektriksel Özellikleri
SF 6 gazı oldukça elektronegatiftir. Yüksek elektronegatiflik nedeniyle, devre kesicinin kontakları arasındaki ark nedeniyle oluşan serbest elektronları emer. Serbest elektronların moleküllerle kombinasyonu, çok düşük hareketliliğe sahip ağır ve büyük iyonlar üretir. Serbest elektronların absorpsiyonu ve iyonların düşük hareketliliği nedeniyle SF6 , çok mükemmel dielektrik özelliğe sahiptir. SF6 gazının dielektrik dayanımı havanınkinden yaklaşık 2,5 kat daha fazladır.
| SF6 Gazı Özellikleri Tablosu | |
| 20 °C’de yoğunluk | 6,14 kg / m 3 |
| Gazın Rengi | Renksiz |
| Moleküler ağırlık | 146.06 |
| Termal iletkenlik | 0.0136 ağırlık / mK |
| Kritik sıcaklık | 45,55 ºC |
| Kritik Yoğunluk | 730 Kg / m 3 |
| Kritik Basınç | 3,78 MPa |
| SF 6’da Ses Hızı | 136 m / s. Havadakinden 3 kat daha az |
| Kırılma indisi | 1.000783 |
| Oluşum Isısı | -1221.66 Kg / mol |
| Özısı | 96.6 j / mol K |
| Basınca Göre Arıza Alanı | 89 V / m Pa |
| 25 ºC’de ve 1 bar mutlak değerde Bağıl Dielektrik Sabit | 1.00204 |
| 25 ºC ve 1 bar mutlakta Dağılma Faktörü veya tan | <2 × 10 -7 |






